interacciones intermoleculares.
Dentro de una molécula, los átomos están unidos mediante fuerzas intramoleculares (enlaces iónicos, metálicos o covalentes, principalmente). Estas son las fuerzas que se deben vencer para que se produzca un cambio químico. Son estas fuerzas, por tanto, las que determinan las propiedades químicas de las sustancias.
Sin embargo existen otras fuerzas intermoleculares que actúan sobre distintas moléculas o iones y que hacen que éstos se atraigan o se repelan.
Generalmente, las fuerzas intermoleculares son mucho más débiles que las intramoleculares. Así, por ejemplo, se requiere menos energía para evaporar un líquido que para romper los enlaces de las moléculas de dicho líquido. Para entender las propiedades de los distintos estados de la materia, necesitamos comprender y conocer los distintos tipos de fuerzas intermoleculares.
Los átomos de un molécula se mantienen unidos por enlaces químicos cuya fuerza va de 150 a 1000 kJ/mol. Otras fuerzas de atracción más débiles, llamadas fuerzas intermoleculares o atracciones intermoleculares, atraen una molécula a otra. Por ejemplo, se requieren 1652 kJ para romper 4 moles de enlaces covalentes CH4 y separar el átomo de C y los cuatro átomos de H de todas las moléculas de 1 mol de metano:
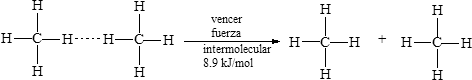
Pero sólo se requieren 8.9 kJ para separar unas de otras 1 mol de moléculas de metano que están muy juntas en el metano líquido, a fin de evaporar el líquido y convertirlo en gaseoso.
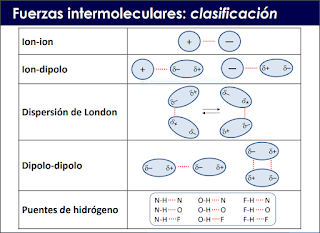
Por lo general como ya se habia dicho anteriormente las fuerzas intermoleculares son débiles pero, al ser muy numerosas, su contribución es importante. estas son los distintos tipos de fuerzas.
fuerzas electroestaticas (ion-ion)
Son las que se establecen entre iones de igual o distinta carga:
- Los iones con cargas de signo opuesto se atraen
- Los iones con cargas del mismo signo se repelen
esto quiere decir que entre mayor carga el radio de los atomos sera menor.
INTERACCIONES HIDROFÓBICAS
En un medio acuoso, las moléculas hidrofóbicas tienden a asociarse por el simple hecho de que evitan interaccionar con el agua. Lo hace por razones termodinámicas: las moléculas hidrofóbicas se asocian para inimizar el número de moléculas de agua que puedan estar en contacto con las moléculas hidrofóbicas.
fuerzas electroestaticas (ion-dipolo inducido)
Tienen lugar entre un ión y una molécula apolar. La proximidad del ión provoca una distorsión en la nube electrónica de la molécula apolar que convierte (de modo transitorio) en una molécula polarizada. En este momento se produce una atracción entre el ión y la molécula polarizada.
| Añadir leyenda |
fuerzas de Van Der Waals (fuerzas de london o de dispersion)
Las fuerzas de Van der Waals (también denominadas fuerzas de dispersión) son las interacciones más débiles existentes entre moléculas, y se dan mayormente entre dos moléculas apolares (es decir, moléculas cuyas densidades electrónicas estan distribuídas uniformememnte en el espacio). Esta interacción puede darse debido a que, por momentos, las moléculas apolares generan dipolos momentáneos (Animación EII-1), lo que permite que puedan interaccionar durante esos periodos de tiempo, sin embargo, al ser tan rápidos, la fuerza de esta interacción es sumamente fácil de romper, razón por la cual, la mayoría de las sustancias con fuerzas de Van der Waals como interacción principal presentan un estado de agregación menor, en comparación con sustancias de peso similar.
La intensidad de las fuerzas de London depende de la facilidad con que se polarizan los electrones de una molécula, y eso depende del número de electrones en la molécula y de la fuerza con que los sujeta la atracción nuclear. En general, cuantos más electrones haya en una molécula más fácilmente podrá polarizarse. Así, las moléculas más grandes con muchos electrones son relativamente polarizables. En contraste, las moléculas más pequeñas son menos polarizables porque tienen menos electrones. Las fuerzas de London varían entre aproximadamente 0.05 y 40 kJ/mol.
La intensidad de las fuerzas de London depende de la facilidad con que se polarizan los electrones de una molécula, y eso depende del número de electrones en la molécula y de la fuerza con que los sujeta la atracción nuclear. En general, cuantos más electrones haya en una molécula más fácilmente podrá polarizarse. Así, las moléculas más grandes con muchos electrones son relativamente polarizables. En contraste, las moléculas más pequeñas son menos polarizables porque tienen menos electrones. Las fuerzas de London varían entre aproximadamente 0.05 y 40 kJ/mol.
Las fuerzas de van der Waals incluyen:
Fuerzas dipolo-dipolo (también llamadas fuerzas de Keesom), entre las que se incluyen los puentes de hidrógeno.
Fuerzas dipolo-dipolo inducido (también llamadas fuerzas de Debye).
Fuerzas dipolo instantáneo-dipolo inducido (también llamadas fuerzas de dispersión o fuerzas de London).

fuerzas dipolo-dipolo inducido
algunos ejemplos de estas son: gases apolares como el O2, el N2 o el CO2 que se pueden disolver en agua.

un poco mas sobre las fuerzas intermoleculares e intramoleculares.
FUERZAS DIPOLO INSTANTÁNEO-DIPOLO INDUCIDO
Las fuerzas de dispersión son fuerzas atractivas débiles que se establecen fundamentalmente entre sustancias no polares, aunque también están presentes en las sustancias polares. Se deben a las irregularidades que se producen en la nube electrónica de los átomos de las moléculas por efecto de la proximidad mutua. La formación de un dipolo instantáneo en una molécula origina la formación de un dipolo inducido en una molécula vecina de manera que se origina una débil fuerza de atracción entre las dos.
Puente de Hidrógeno
La interacción puente de Hidrógeno es un caso especial de una interacción dipolo-dipolo, que se produce cuando un átomo de Hidrógeno, que se encuentra enlazado a un átomo de N, O o F, interacciones con un átomo de N, O o F de otra molécula. Debido a sus características, el puente de Hidrógeno es la interacción intermolecular más fuerte, lo que provoca que las sustancias que poseen esta interacción como la principal, presenten un estado de agregación mayor (comparado con sustancias con pesos similares). Esto puede apreciarse en la Imagen EII-3.
Es debida a la naturaleza fortísimamente polar del enlace, ya que N, O y F son átomos muy electronegativos.
Imagen EII-3: Puente de Hidrógeno entre dos moléculas de agua.
un poco mas sobre las fuerzas intermoleculares e intramoleculares.

No hay comentarios:
Publicar un comentario